Перейти к:
Инновации в контактной коррекции: создание биомиметической поверхности
https://doi.org/10.33791/2222-4408-2023-3-235-243
Аннотация
Около 60 % пользователей контактных линз предпочитают линзы плановой замены. Несмотря на то что в последние годы появилось много технологических усовершенствований и инноваций, улучшающих свойства контактных линз, в категории плановой замены было не так много достижений. Для удовлетворения потребностей пациентов, предпочитающих линзы плановой замены, необходимы новые технологии. Эксперты представляют концепцию биомимикрии и то, как она улучшает взаимодействие между контактной линзой и глазной поверхностью.
Ключевые слова
Для цитирования:
Ишихара К., Папас Э., Пруитт Д., Куннен К., Мак К., Бауман Э., Хонг Й. Инновации в контактной коррекции: создание биомиметической поверхности. The EYE ГЛАЗ. 2023;25(3):235-243. https://doi.org/10.33791/2222-4408-2023-3-235-243
For citation:
Ishihara K., Papas E., Pruitt J., Kunnen C., Mack C., Bauman E., Hong Ye. Material science: biomimetic surface enhancement. The EYE GLAZ. 2023;25(3):235-243. (In Russ.) https://doi.org/10.33791/2222-4408-2023-3-235-243
Контактные линзы (КЛ) ежемесячной замены – наиболее востребованный режим плановой замены, который предпочитают многие пользователи. Согласно результатам многочисленных опросов, от 32 до 36 % пользователей предпочитают срок замены 1 месяц [1]. Учитывая такую высокую востребованность, удивительно, что развитие инновационных технологий для этой категории линз пока отстает от прогресса в области линз однодневной замены.
Одной из новейших разработок в категории линз однодневной замены является запатентованная технология водоградиентного материала из полимера делефилкон A. Эта технология позволила создать линзу, которая обеспечивает превосходную смачиваемость и очень высокую степень кислородной проницаемости [2]. Полимер данной линзы представляет собой переход от дышащего силикон-гидрогелевого материала в сердцевине к несиликоновой гидрофильной полимерной структуре на поверхности. Этот подход позволяет обеспечить характеристики, недостижимые с обычными полимерами: Dk/t 156 (для линзы –3,00 дптр) и влагосодержание на поверхности почти 100 % (табл. 1) [2].
Таблица 1. Технические характеристики
контактных линз Alcon Dailies Total1 и материала делефилкон А
Table 1. Delefilcon A material specifications in Alcon Dailies Total1 lenses
Название материала USAN material name | Делефилкон А Delefilcon A |
Группа материала Material group | V |
Влагосодержание (сердцевина), % Water content (core), % | 33 |
Влагосодержание (поверхность), % Water content (surface), % | >80 |
Dk (заявленный производителем), баррер Dk (manufacture quoted), barrers | 140 |
Толщина в центре (для линзы –3,00 дптр), мм Center thickness (for lens –3.00 D), mm | 0,09 0.09 |
Dk/t (для линзы –3,00 дптр), баррер/мм Dk/t (for lens –3.00 D), barrers/mm | 156 |
Модуль упругости сердцевины, МПа Core modulus, MPa | 0,7 0.7 |
Тонирование для удобства обращения Handling Tint | Для визуализации линзы VisitintТМ |
УФ-фильтр UV-blocker | Нет No |
Диаметр, мм Diameter, mm | 14,1 14.1 |
Базовая кривизна, мм Base curve, mm | 8,5 8.5 |
Несмотря на отсутствие непреодолимых препятствий для использования водоградиентной технологии для линз плановой замены, существуют специфические проблемы, которые необходимо решить для адаптации этой технологии для многоразового использования. Для КЛ плановой замены важны определенные свойства:
- усиленная защита от инфекций,
- совместимость с дезинфицирующими растворами для ухода за линзами,
- устойчивость к потенциально раздражающим отложениям,
- высокая износостойкость.
Биомиметический: что это значит?
Хотя такие термины, как «бионический», «биомиметический» и «биомимикрия», являются широко используемыми, они часто не имеют четких определений и иногда употребляются неправильно. Биомиметика включает изучение природы и природных явлений для того, чтобы понять принципы их функционирования, почерпнуть из них идеи и применить концепции, которые могут быть полезны для науки, инженерии и медицины [2][3]. Термины «биомимикрия», «биомиметика» и «биоинспирация» имеют различные определения.
Биомимикрию можно рассматривать как поверхностное подражание биологическим системам. Биомиметика означает копирование и воспроизведение взаимосвязи между структурой и функцией, наблюдаемой у живых организмов. Биоинспирация (биовдохновение) – это процесс, в котором структура и функция выходят за рамки природного примера и служат стимулом для создания продукта [4]. Диаграмма ниже (рис. 1) показывает, как биологические, биомиметические и биовдохновленные системы, являясь отдельными, могут работать вместе.
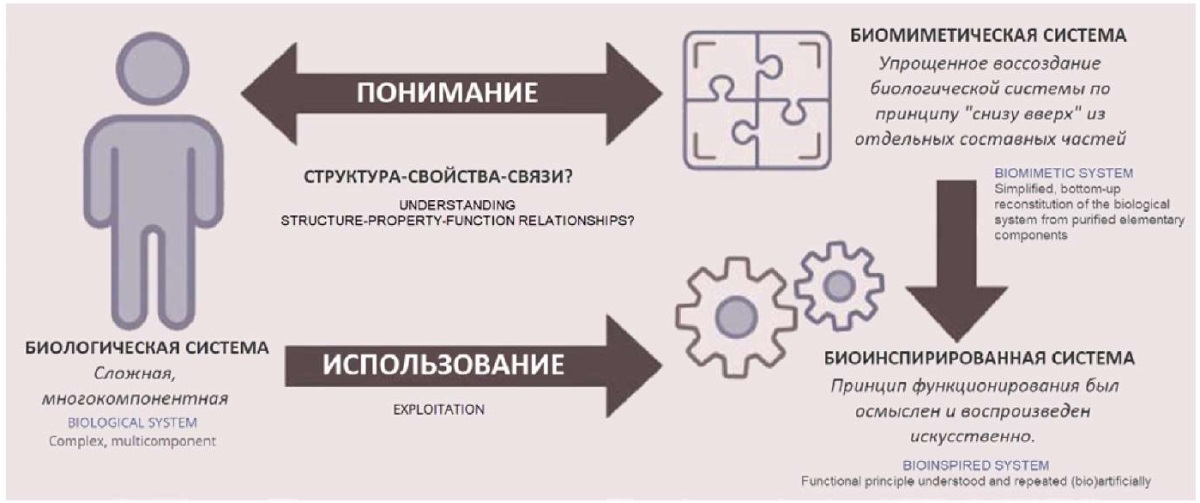
Рис. 1. Как биологические, биомиметические и биоинспирированные системы
могут работать вместе
Fig. 1. How biological, biomimetic, and bio-inspired systems can work together
Термин «биомиметический» в контексте контактных линз относится к широкому спектру подходов к дизайну и производству, которые различаются по степени близости к приведенному выше определению. Во многих случаях продукт называют биомиметическим, даже если подход никак не связан с биологией глаза. Например, гиалуроновая кислота (ГК) – это гликозаминогликан природного происхождения, который широко распространен во многих тканях. Она используется в различных слезозаменителях для повышения вязкости и улучшения удержания влаги [5]. Была разработана контактная линза, позиционируемая как биомиметическая, покрытая белком, связанным с ГК, с целью увеличения удержания воды линзой [6]. Эта технология представляет интересный подход к улучшению смачиваемости линзы, но, похоже, она была вдохновлена свойствами искусственной слезы, а не свойствами роговицы.
Биомиметическая поверхность контактных линз
Роговица человека – удивительная структура, и не только благодаря своей преломляющей способности. Хотя она постоянно подвергается воздействию условно-патогенных и потенциально патогенных микробов из окружающей среды, она редко воспаляется или инфицируется, что свидетельствует о наличии мощной и высокоэффективной системы защиты [7]. При разработке идеальной контактной линзы ежемесячной замены стоит опираться на наше понимание свойств роговицы и использовать эти знания для создания и изготовления поверхности контактной линзы.
Поверхность эпителия роговицы по своей природе гидрофобна, но существует несколько факторов, которые способствуют формированию гидрофильной поверхности. Наружный слой эпителия роговицы покрыт многочисленными микроворсинками, а бокаловидные клетки конъюнктивы вырабатывают муцин, который мигрирует по поверхности эпителия. Муцин покрывает эпителиальные микроворсинки, образуя гликокаликс. Благодаря распределению слоя муцина по поверхности роговицы, она становится гидрофильной [8]. Глазные муцины участвуют в формировании муцинового слоя слезной пленки и удерживают слезу на поверхности роговицы. Эти молекулы также препятствуют адгезии патогенных микроорганизмов к глазной поверхности.
Протеогликаны (люмикан, кератокан и мимекан) и фибриллярные белки (коллагены VI и XII типа) необходимы для поддержания прозрачности роговицы [9].
Наружный и базальный слои эпителия роговицы высоко специализированы. Клетки наружного эпителия имеют небольшие выступы, называемые микроскладками, которые увеличивают площадь эпителиальной поверхности. На поверхности микроскладок гликопротеины класса мембраноассоциированных муцинов образуют гликокаликс [10]. Этот богатый муцином слой формирует гидрофильную поверхность, по которой может распространяться слезная пленка, смазывая глазную поверхность и создавая барьер для патогенов [11]. Как мы можем воспроизвести эту сложную структуру поверхности на контактной линзе?
2-Метакрилоилоксиэтил фосфорилхолин
2-Метакрилоилоксиэтил фосфорилхолин (МФХ) – это водорастворимая молекула, содержащая гидрофобные метакрилатные и гидрофильные фосфорилхолиновые (ФХ) группы (рис. 2, 3) [12]. Такая структура позволяет модифицировать гидрофобные поверхности подобно молекулам муцина и гликокаликсу.
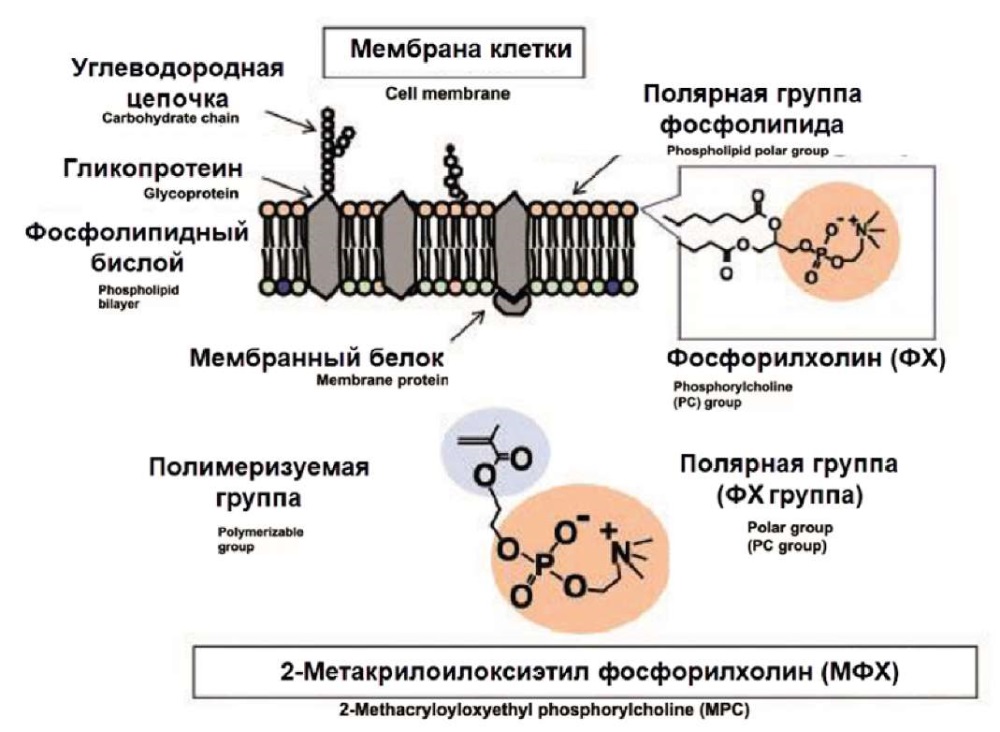
Рис. 2. Химическая структура МФХ
Fig. 2. The chemical structure of MPC
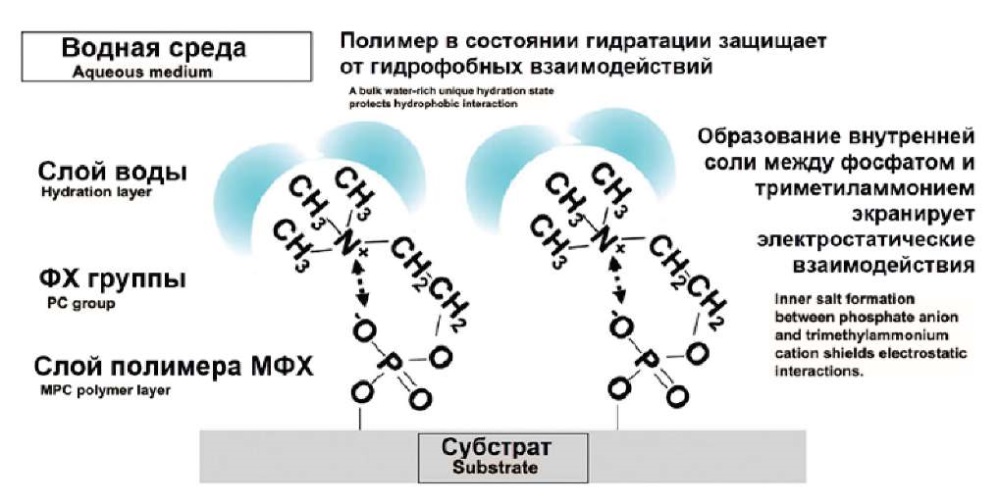
Рис. 3. Состояние гидратации полимера MФХ в водной среде
Fig. 3. Hydration state of the MPC polymer at the aqueous interface
Цвиттер-ионная группа фосфорилхолина в боковой цепи молекулы MФХ придает полимеру биоинертные свойства. Когда на поверхности линзы формируется слой полимера MФХ, он гидратируется за счет взаимодействия групп ФХ с молекулами воды, обеспечивая поверхности увлажненность и смазывающую способность. Важно отметить, что чистый нейтральный заряд ФХ не притягивает заряженные молекулы белка или других отложений [12][13]. С момента их разработки полимеры МФХ использовались во многих медицинских изделиях с целью предотвращения неблагоприятных биологических реакций, а исследования показали, что они подавляют адсорбцию белков и адгезию клеток к различным материалам [14].
Эти свойства обусловлены тремя важнейшими характеристиками полимера МФХ:
- чрезвычайная гидрофильность,
- электрическая нейтральность,
- способность ФХ формировать и удерживать объем в водной среде [14].
Когда молекула находится внутри жидкости, она притягивается к соседним молекулам во всех направлениях, в результате чего чистая сила, действующая на нее, равна нулю. Однако, когда молекула находится на поверхности, чистая сила действует на нее в направлении внутрь, создавая поверхностное натяжение [14]. Группы ФХ способствуют естественному движению воды, что превосходит показатели, достигаемые другими контактными линзами. Снижение поверхностного натяжения улучшает смачиваемость контактных линз [15].
МФХ может применяться для создания молекулярных структур с индивидуально настраиваемыми свойствами благодаря различной последовательности методов полимеризации, включая живую радикальную полимеризацию [13]. Полимер МФХ может быть использован для создания поверхности, схожей с клеточной мембраной [16]. Материал нетоксичен и уже применяется в широком спектре биомедицинских устройств, включая биосенсоры, сердечно-сосудистые стенты, имплантируемые кровяные насосы, микрокатетеры, искусственные тазобедренные суставы и шовные материалы.
Влияние МФХ на свойства контактной линзы
Биоинспирированный полимер MФХ имеет большой потенциал в улучшении защитных свойств, биосовместимости и смачиваемости материалов для контактных линз [16]. Полимерное покрытие МФХ имитирует поверхность роговицы и может функционировать аналогичным образом.
1. Устойчивость к инфекции
Роговица имеет несколько механизмов, которые способствуют защите от инфекции. Естественная защита включает антимикробные пептиды, связанные с эпителием, многослойную структуру эпителия, антимикробную активность слезной пленки, барьерную функцию базальной пластинки и постоянную популяцию антибактериальных клеток в эпителии [7]. Эти защитные механизмы могут быть нарушены в результате ношения контактных линз. Адгезия бактерий к контактным линзам – это нежелательное явление, связанное с риском развития инфекции [18]. Бактерии, вызывающие загрязнение контактных линз (например, Pseudomonas aeruginosa [19][20]), часто сохраняются на линзах в виде биопленок [18]. Таким образом, для уменьшения риска осложнений важно уменьшить или предотвратить образование этих биопленок [18].
Сложная структура поверхности роговицы с большой долей точности имитируется структурой полимера MФХ (рис. 4, 5) [14][21][22]. Биомиметическая структура слоя MФХ уменьшает адгезию бактерий к контактным линзам и помогает обеспечить защиту от инфекции. Исследования показали, что нанесение на поверхность полимера MФХ значительно снижает прикрепление патогенных для человека микроорганизмов [23].

Рис. 4. Нанесение МФХ на поверхность.
Изображение поверхности, полученное с помощью просвечивающей
электронной микроскопии, показано справа
Fig. 4. Application of MPC to a surface.
A transmission electron microscopy image of the surface is shown on the right
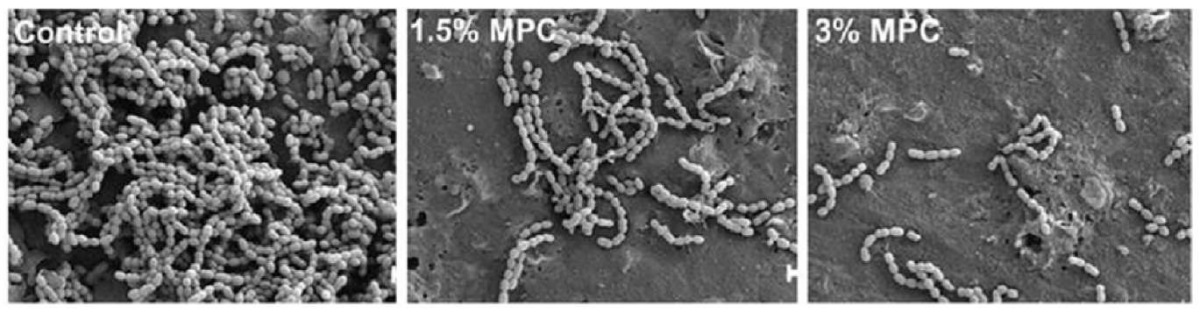
Рис. 5. Качественные изображения бактерий,
прикрепившихся к поверхности без MФХ (контроль)
и с покрытием из 1,5 и 3,0 % MФХ,
полученные с помощью сканирующего электронного микроскопа
Fig. 5. Qualitative scanning electron microscopic images of bacteria
attached to the surfaces without MPC (control)
and with coating of 1.5 and 3.0 % MPC
Например, адгезия Staphylococcus aureus, Streptococcus mutans, P. aeruginosa и Candida albicans к трем различным поверхностям уменьшилась после нанесения на поверхность полимера MФХ [23]. Этот эффект был объяснен «супергидрофильностью» поверхности из полимера MФХ [23] и подтверждается данными исследований, указывающими на то, что адгезии и образованию биопленок P. aeruginosa способствует гидрофобная поверхность [19]. Исследования продемонстрировали способность полимера MФХ ингибировать образование бактериальных биопленок (рис. 5) [24]. Кроме того, способность полимера MФХ подавлять бактериальную адгезию на широком спектре поверхностей не ставит под угрозу безопасность или биосовместимость. Например, было показано, что ополаскиватель для полости рта на основе полимера MФХ является безопасным и эффективным в предотвращении бактериальной адгезии на тканях полости рта [25].
2. Белковые отложения
Во время ношения на линзах могут накапливаться отложения в результате взаимодействия со слезной пленкой. Накопление белковых отложений на гидрогелевых контактных линзах зависит от влагосодержания, поверхностного заряда, гидрофобности и размера пор материала линзы [26]. Отложения на контактных линзах негативно влияют на ощущения пользователя и здоровье глаз, снижая смачиваемость поверхности линзы и вызывая дискомфорт [27]. Они также могут привести к осложнениям, связанным с контактными линзами, включая папиллярный конъюнктивит, точечный кератит и воспалительные процессы роговицы [28][29].
Сразу после надевания на глаз контактные линзы начинают покрываться слоем белка. Большая часть протеинов прочно прикрепляется к материалу, только 50 % белковых отложений удаляются с помощью обычных процедур ухода [30]. Белки, прикрепившиеся к контактным линзам, могут денатурироваться, но связь между этими изменениями и снижением комфорта при ношении контактных линз точно не установлена [31]. Однако предполагается, что структурные изменения белков и антибактериальные белки, накапливающиеся на гидрогелевых линзах, могут влиять на антимикробные свойства глазной поверхности, повышать риск прикрепления бактерий и развития инфекции [19][32]. Было установлено, что накопление определенных белков на контактных линзах повышает риск прикрепления микробных клеток к материалу линзы, что также связано с воспалительными осложнениями [30].
Протеомный анализ показал, что лизоцим и липокалин 1 являются наиболее распространенными белковыми отложениями, обнаруженными на контактных линзах [33]. Связывание лизоцима с некоторыми материалами контактных линз может привести к денатурации белка в «неактивную» форму [34]. Исследования показали, что воздействие денатурированного лизоцима может снижать метаболическую активность и жизнеспособность эпителиальных клеток роговицы человека, а также увеличить выделения провоспалительных цитокинов [34]. Цитокины, экспрессия которых возрастает в ответ на денатурированный лизоцим, включают различные интерлейкины (1b, 2, 4, 6, 8, 10, 12 и 13), интерферон-γ и фактор некроза опухоли. Эти цитокины способны вызывать раздражение и воспаление при ношении контактных линз [34][35].
В линзах с покрытием из полимера МФХ наблюдалось снижение адсорбции белков на 83 % для лизоцима и 73 % для бычьего сывороточного альбумина (рис. 6) [37]. Эти результаты были повторены в другом исследовании, в котором оценивали способность полимерного покрытия МФХ снижать адгезию белков и липидов к различным контактным линзам [38].
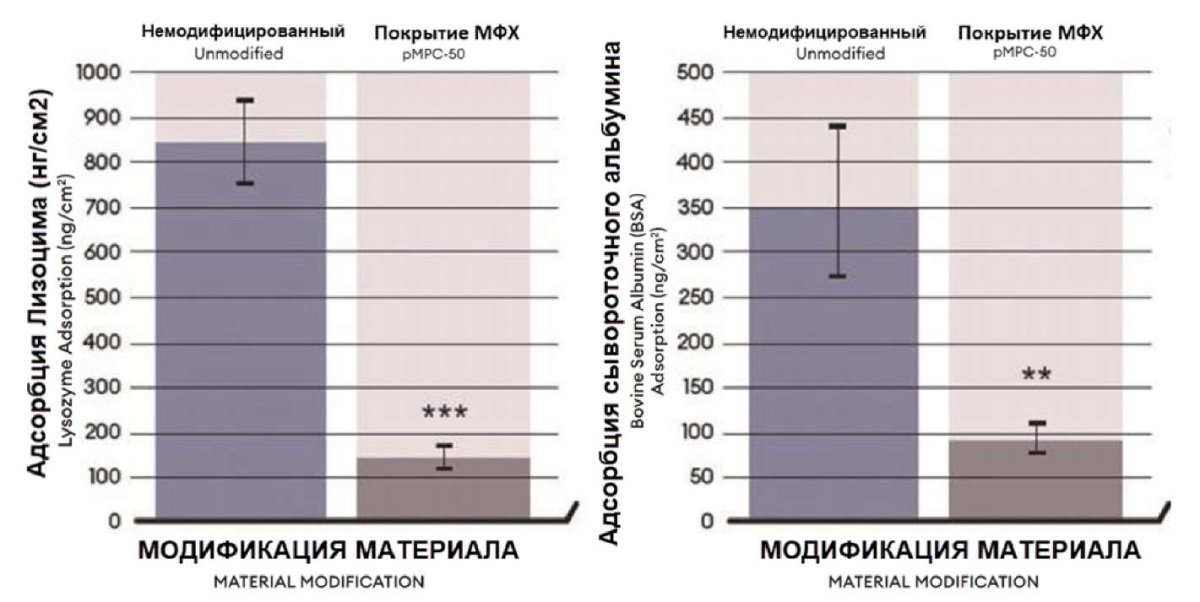
Рис. 6. Количество адсорбированного лизоцима (1,9 мг/мл)
и бычьего сывороточного альбумина (0,2 мг/мл)
на немодифицированных и модифицированных полиМФХ-50 (пМФХ-50)
образцах силиконовых гидрогелевых линз после 24-часового периода инкубации
Fig. 6. Amount of lysozyme (1.9 mg/ml) and bovine serum albumin (0.2 mg/ml)
adsorbed to unmodified vs polyMPC-50 (pMPC-50)
modified model silicone hydrogel lenses after a 24-hour incubation period
Нанесение слоя полимера МФХ на поверхность других материалов с помощью свободнорадикальной полимеризации приводит к снижению адсорбции белков и улучшению биосовместимости [36]. Исследование показало уменьшение адгезии потенциально загрязняющих молекул к контактным линзам [37]. Причем именно покрытие силикон-гидрогелевых линз тонким слоем полимера МФХ, а не присутствие его в толще материала линзы увеличило как смачиваемость поверхности, так и равновесное влагосодержание материала.
Очень высокая гидрофильность МФХ, аналогичная гидрофильности поверхности роговицы, расценивается как наиболее вероятная причина предотвращения неспецифического связывания белков с этим материалом [39]. Наличие цвиттер-ионных цепочек МФХ значительно снижает адсорбцию белков и бактерий модифицированным материалом благодаря уникальному гидрофильному слою, образуемому полимерным слоем МФХ на поверхности линзы [12][39][40]. Кроме того, было показано, что полимерное покрытие МФХ снижает адгезию белков и других веществ к широкому спектру материалов, регулярно контактирующих с биологическими жидкостями в различных медицинских изделиях [14][41].
3. Долговечность
Стойкость полимерного покрытия МФХ еще предстоит оценить на контактных линзах, однако было показано, что его защитные свойства остаются неизменными после испытания на трение, включившего 500 циклов чистки зубов после нанесения на материалы зубных протезов [42]. Более того, нанесение полимера МФХ на поверхность полиэтилена привело к очень стабильным защитным свойствам, даже когда он был подвергнут тесту на трение с 20 миллионами циклов [43]. Эти результаты подтверждают долговечность самого полимера МФХ и показывают, что он хорошо подходит для модификации поверхности контактных линз ежемесячной замены.
Снижение дропаутов (прекративших ношение КЛ)
Вышеупомянутые характеристики потенциально способны снизить процент отказов от ношения контактных линз. Сочетание технологии водного градиента с биомиметической поверхностью линз способно обеспечить очень высокую степень комфорта [45]. Поверхность линз на основе полимера MФХ имитирует поверхность роговицы, предотвращая прикрепление белков и бактерий, которые также могут быть причиной прекращения использования линз [46][47].
Выводы
Разработка новых контактных линз плановой замены требует сочетания лучших существующих технологий и биомиметического подхода с использованием материалов со свойствами, аналогичными поверхности роговицы, таких как МФХ.
Линзы из биомиметических материалов имеют потенциал для повышения комфорта и безопасности, а также для уменьшения количества отказов от ношения контактных линз среди пользователей МКЛ плановой замены.
Список литературы
1. Nichols J.J., Starcher L. Contact lenses 2019. Contact Lens Spectrum. 2020;35:18,19,21–25. URL: https://www.clspec-trum.com/issues/2020/january-2020/contact-lenses-2019 (Accessed: 01.01.2020).
2. Pruitt J., Bauman E. The development of Dailies Total1 water gradient contact lenses. Contact Lens Spectrum. 2013:40–44. URL: https://www.clspectrum.com/supplements/2013/june-2013/the-world-x0027;s-first-and-only-water-gradient-c/font-color-000000-special-edition-2013-font-(11) (Accessed 01/01/2020)
3. Omali N.B., Zhu H., Zhao Z., Willcox M.D. Protein deposition and its effect on bacterial adhesion to contact lenses. Optometry & Vision Science. 2013;90:557–564. https://doi.org/10.1097/opx.0b013e318292bb13
4. Khan S.A., Lee C.S. Recent progress and strategies to develop antimicrobial contact lenses and lens cases for different types of microbial keratitis. Acta Biomaterials. 2020;113:101– 118. https://doi.org/10.1016/j.actbio.2020.06.039
5. Yeung K.K., Dinh C.K. Dissecting the soft contact lens. Review of Optometry. August 15, 2018. URL: https://www.reviewo-foptometry.com/article/dissecting-the-soft-contact-lens (Accessed 15/01/2021)
6. American Optometric Association. Contact Lens Care. 2020. URL: https://www.aoa.org/healthy-eyes/vision-and-vi-sion-correction/contact-lens-care?sso=y (Accessed 15/01/2021)
7. Fleiszig S.M.J., Kroken A.R., Nieto V. et al. Contact lens-related corneal infection: intrinsic resistance and its compromise. Progress in Retina & Eye Research. 2020;76:100804. https://doi.org/10.1016/j.preteyeres.2019.100804
8. Mayers M. An overview of the cornea and CL surface chemistry. Review of Cornea & Contact Lens. 2010. URL: https://www.reviewofcontactlenses.com/article/an-over-view-of-the-cornea-and-cl-surface-chemistry (Accessed 15/01/2021).
9. Kurpakus Wheater M., Kernacki K.A., Hazlett L.D. Corneal cell proteins and ocular surface pathology. Biotechnology Histochemistry. 1999;74:146–159. https://doi.org/10.3109/10520299909047967
10. Gipson I.K. Distribution of mucins at the ocular surface. Experimental Eye Research. 2004;78:379–388. https://doi.org/10.1016/s0014-4835(03)00204-5
11. Gipson I.K., Argüeso P. Role of mucins in the function of the corneal and conjunctival epithelia. International Review of Cytology. 2003;231:1–49. https://doi.org/10.1016/s0074-7696(03)31001-0
12. Ishihara K., Mu M., Konno T., Inoue Y., Fukazawa K. The unique hydration state of poly (2-methacryloyloxyethyl phosphorylcholine). Journal of Biomaterials Science and Polymer Education. 2017;28:884–899. https://doi.org/10.1080/09205063.2017.1298278
13. Goda T., Ishihara K., Miyahara Y. Critical update on 2-methacryloyloxyethyl phosphorylcholine (MPC) polymer science. Journal of Applied Polymer Science. 2015;1–10. https://doi.org/10.1002/app.41766
14. Ishihara K. Revolutionary advances in 2-methacryloyloxy-ethyl phosphorylcholine polymers as biomaterials. Journal of the Biomedical and Material Research Association. 2019;107:933– 943. https://doi.org/10.1002/jbm.a.36635
15. Dursch T., Svitova T.F., Meng S.C. Advances in soft lens materials and designs. Contact Lens Spectrum. 2015;30:20–23. URL: https://www.clspectrum.com/issues/2015/december-2015/advances-in-soft-lens-materials-and-designs (Accessed 15/01/2021).
16. Goda T., Ishihara K. Soft contact lens biomaterials from bioinspired phospholipid polymers. Expert Reviews of Medical Devices. 2006;3:167–174. https://doi.org/10.1586/17434440.3.2.167
17. Kaneko T., Saito T., Shobuike T. et al. 2-Methacryloyloxyethyl phosphorylcholine polymer coating inhibits bacterial adhesion and biofilm formation on a suture: an in vitro and in vivo study. Biomedical Research International. 2020;2020:5639651. https://doi.org/10.1155/2020/5639651
18. Tam C., Mun J.J., Evans D.J., Fleiszig S.M. The impact of inoculation parameters on the pathogenesis of contact lens-related infectious keratitis. Investigative Ophthalmology & Vision Science. 2010;51:3100–3106. https://doi.org/10.1167%2Fio-vs.09-4593
19. Dutta D., Cole N., Willcox M. Factors influencing bacterial adhesion to contact lenses. Molecular Vision. 2012;18:14–21.
20. Hilliam Y., Kaye S., Winstanley C. Pseudomonas aeruginosa and microbial keratitis. Journal of Medical Microbiology. 2020;69:3–13. https://doi.org/10.1099/jmm.0.001110
21. Gipson I.K. The ocular surface: the challenge to enable and protect vision: the Friedenwald lecture. Investigative Ophthalmology & Vision Science. 2007;48:4390–4398. https://doi.org/10.1167/iovs.07-0770
22. Carraway K.L., Price-Schiavi S.A., Komatsu M. et al. Multiple facets of sialomucin complex/MUC4, a membranemucin and erbb2 ligand, in tumors and tissues (Y2K update). Frontiers in Bioscience. 2000;5:D95–D107. https://doi.org/10.2741/car-raway
23. Hirota K., Murakami K., Nemoto K., Miyake Y. Coating of a surface with 2-methacryloyloxyethylphosphorylcholine (MPC) co-polymer significantly reduces retention of human pathogenic microorganisms. FEMS Microbiology Letters. 2005;248:37–45. https://doi.org/10.1016/j.femsle.2005.05.019
24. Lee M.J., Kwon J.S., Kim J.Y. et al. Bioactive resin-based composite with surface pre-reacted glass-ionomer filler and zwitterionic material to prevent the formation of multi-species biofilm. Dental Materials. 2019;35:1331–1341. https://doi.org/10.1016/j.dental.2019.06.004
25. Fujiwara N., Yumoto H., Miyamoto K. et al. 2-Methacryloyloxyethyl phosphorylcholine (MPC)polymer suppresses an increase of oral bacteria: a single-blind, crossover clinical trial. Clinical Oral Investigations.2019;23:739–746. https://doi.org/10.1007/s00784-018-2490-2
26. Boost M., Cho P., Wang Z. Disturbing the balance: effect of contact lens use on the ocular proteome and microbiome. Clinical & Experimental Optometry. 2017;100:459–472. https://doi.org/10.1111/cxo.12582
27. Truong T.N., Graham A.D., Lin M.C. Factors in contact lens symptoms: evidence from a multi-study database. Optometry & Vision Science. 2014;91:133–141. https://doi.org/10.1097/opx.0000000000000138
28. Iskeleli G., Ozkiris A., Tanidir R., Kizilkaya M. Comparison of conventional and frequent replacement daily wear soft contact lenses. Contactologia. 2000;22:84–88. URL: https://avesis.iuc.edu.tr/yayin/04dd97d1-64f4-40ee-aaf0-d92cb476b30a/a-comparison-of-conventional-and-frequent-replacement-dai-ly-wear-soft-contact-lenses
29. Kenny S.E., Tye C.B., Johnson D.A., Kheirkhah A. Giant papillary conjunctivitis: a review. Ocular Surface. 2020;18:396–402. https://doi.org/10.1016/j.jtos.2020.03.007
30. Luensmann D., Jones L. Protein deposition on contact lenses: the past, the present, and the future. Contact Lens & Anterior Eye. 2012;35:53–64. https://doi.org/10.1016/j.clae.2011.12.005
31. Subbaraman L.N., Glasier M.A., Varikooty J., Srinivasan S., Jones L. Protein deposition and clinical symptoms in daily wear of etafilcon lenses. Optometry & Vision Science. 2012;89:1450– 1459. https://doi.org/10.1097/opx.0b013e318269e583
32. Vijay A.K., Zhu H., Ozkan J. et al. Bacterial adhesion to unworn and worn silicone hydrogel lenses. Optometry & Vision Science. 2012;89:1095–1106. https://doi.org/10.1097/opx.0b013e318264f4dc
33. Zhao Z., Wei X., Aliwarga Y., Carnt N.A., Garrett Q., Willcox M.D. Proteomic analysis of protein deposits on worndaily wear silicone hydrogel contact lenses. Molecular Vision. 2008;14:2016–2024. https://pubmed.ncbi.nlm.nih.gov/18989384
34. McCanna D.J., Oh S., Seo J. et al. The effect of denatured lysozyme on human corneal epithelial cells. Investigative Ophthalmology & Vision Science. 2018;59:2006–2014. https://doi.org/10.1167/iovs.17-22260
35. Schulz C. Ocular inflammation. General Intermediate Medical Clinical Innovations. 2018;3:1–3.
36. Feng W., Zhu S., Ishihara K., Brash J.L. Adsorption of fibrinogen and lysozyme on silicon grafted with poly (2-methacryloyloxyethyl phosphorylcholine) via surface-initiated atom transfer radical polymerization. Langmuir. 2005;21:5980– 5987. https://doi.org/10.1021/la050277i
37. Spadafora A., Korogiannaki M., Sheardown H. Antifouling silicone hydrogel contact lenses via densely graftedphosphorylcholine polymers. Biointerphases. 2020;15:041013. https://doi.org/10.1116/6.0000366
38. Chang W.-H., Liu P.-Y., Lu C.-J. et al. Reduction of physical strength and enhancement of anti-protein and anti-lipid adsorption abilities of contact lenses by adding 2-methacryloyloxyethyl phosphorylcholine. Macromolecular Research. 2020;28:1064–1073. https://doi.org/10.1007/s13233-020-8149-2
39. Vales T.P., Jee J.P., Lee W.Y. et al. Development of poly (2-methacryloyloxyethyl phosphorylcholine)-functionalized hydrogels for reducing protein and bacterial adsorption. Materials (Basel). 2020;13:943. https://doi.org/10.3390/ma13040943
40. Xiao A., Dhand C., Leung C.M., Beuerman R.W., Ramakrishna S., Lakshminarayanan R. Strategies to designantimicrobial contact lenses and contact lens cases. Journal of Material & Chemical Biology. 2018;6:2171–2186. http://dx.doi.org/10.1039/C7TB03136J
41. Iwasaki Y., Ishihara K. Phosphorylcholine-containing polymers for biomedical applications. Analls of Bioanalytical Chemistry. 2005;381:534–546. https://doi.org/10.1007/s00216-004-2805-9
42. Takahashi N., Iwasa F., Inoue Y., Morisaki H., Ishihara K., Baba K. Evaluation of the durability and antiadhesive action of 2-methacryloyloxyethyl phosphorylcholine grafting on an acrylic resin denture base material. Journal of Prosthetic Dentistry. 2014;112:194–203. https://doi.org/10.1016/j.pros-dent.2013.08.020
43. Ishihara K. Highly lubricated polymer interfaces for advanced artificial hip joints through biomimetic design. Polymer Journal. 2015;47:585–597. http://dx.doi.org/10.1038/pj.2015.45
44. NOF Corporation. Life science products. 2020. URL: https://www.nof.co.jp/english/business/life (Accessed 15/01/2021).
45. Sulley A., Dumbleton K. Silicone hydrogel daily disposable benefits: the evidence. Contact Lens & Anterior Eye. 2020;43:298–307. https://doi.org/10.1016/j.clae.2020.02.001
46. Szczotka-Flynn L.B., Bajaksouzian S., Jacobs M.R., Rimm A. Risk factors for contact lens bacterial contamination during continuous wear. Optometry & Vision Science. 2009;86:1216– 1226. https://doi.org/10.1097%2FOPX.0b013e3181bbca18
47. Rumpakis J.M.B. New data on contact lens dropouts: an international perspective. Review of Optometry. January 15, 2010. URL:
Об авторах
К. ИшихараЯпония
Казухико Ишихара, профессор кафедры материаловедения
113-8654, Токио, Бункио Сити
Э. Папас
Австралия
Эрик Папас, профессор Школы оптометрии и науки о зрении
NSW 2052, Австралия, Сидней, Хай Ст Кенсингтон
Д. Пруитт
Соединённые Штаты Америки
Джон Пруит, инженер-химик подразделения заботы о зрении
TX 76134-2001, ФортУорс, 6201 Саус Фривей
К. Куннен
Соединённые Штаты Америки
Каролина Куннен, старший руководитель проекта по клиническому развитию и медицинским вопросам подразделения заботы о зрении
TX 76134-2001, ФортУорс, 6201 Саус Фривей
К. Мак
Соединённые Штаты Америки
Карла Мак, руководитель глобального отдела по профессиональным вопросам
TX 76134-2001, ФортУорс, 6201 Саус Фривей
Э. Бауман
Соединённые Штаты Америки
Эрих Бауман, старший директор по руководству проектами научно-исследовательского отдела подразделения заботы о зрении
TX 76134-2001, ФортУорс, 6201 Саус Фривей
Йе Хонг
Соединённые Штаты Америки
Йе Хонг, директор по исследованиям и разработкам в области глазного здоровья и сухого глаза
TX 76134-2001, ФортУорс, 6201 Саус Фривей
Рецензия
Для цитирования:
Ишихара К., Папас Э., Пруитт Д., Куннен К., Мак К., Бауман Э., Хонг Й. Инновации в контактной коррекции: создание биомиметической поверхности. The EYE ГЛАЗ. 2023;25(3):235-243. https://doi.org/10.33791/2222-4408-2023-3-235-243
For citation:
Ishihara K., Papas E., Pruitt J., Kunnen C., Mack C., Bauman E., Hong Ye. Material science: biomimetic surface enhancement. The EYE GLAZ. 2023;25(3):235-243. (In Russ.) https://doi.org/10.33791/2222-4408-2023-3-235-243




























